Hace poco más de 30 años, Francis Mojica hizo un descubrimiento revolucionario, aunque no lo pareciera a primera vista. Este biólogo español estaba decidido a investigar cómo era posible que algunas bacterias sobrevivieran en las inhóspitas salinas de Santa Pola (Alicante). Logró averiguarlo. Y este descubrimiento abrió la puerta a un campo mucho más amplio: el de edición genética.
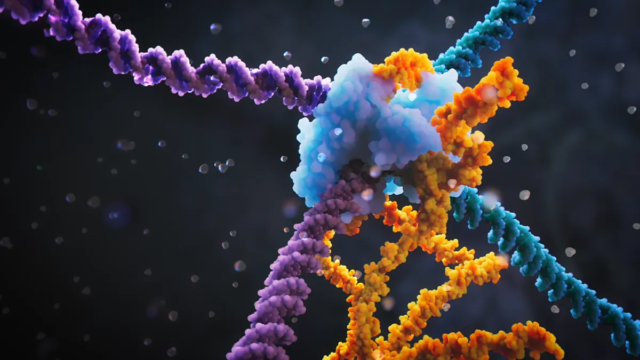
Su investigación sentó las bases para el desarrollo de la herramienta CRISPR/Cas9, una especie de ‘tijeras moleculares’ que permite editar el ADN y por la que las investigadoras Emmanuelle Charpentier y Jennifer Doudna ganaron el Premio Nobel de Química en 2020.
También llamada ‘cortadora-pasta’ genética fue la primera técnica de edición de ADN, una herramienta que ha cambiado el pronóstico de diferentes enfermedades, como la anemia falciforme, y que se ha ido mejorando progresivamente. Este miércoles la revista Naturaleza, publica los detalles de un nuevo salto en esa evolución tecnológica. Se trata de una nueva técnica que permite la inserción, eliminación o inversión de largas secuencias de ADN en posiciones específicas del genoma.
La herramienta, desarrollada por el equipo de Patricio D. Hsude la Universidad de Berkeley, en California (EE.UU.), no se basa en un ‘corta y pega’ genético, sino en una recombinación programable dirigida por una pequeña molécula de ARN, que actúa como ‘puente’. Este enfoque, dicen sus creadores, podría proporcionar una forma más sencilla de llevar a cabo la edición genética. Los científicos detallan los detalles de su desarrollo en dos artículos publicados en Naturaleza.
“Justo cuando pensábamos que nada más podría sorprendernos tras conocer las diferentes versiones de las herramientas CRISPR, llega el laboratorio de Hsu y nos vuelve a asombrar describiendo un nuevo sistema de modificación genética del ADN que promete solucionar las limitaciones de CRISPR”, apunta al respecto de la nueva herramienta. Llus MontoliuInvestigador del Centro Nacional de Biotecnología (CNB-CSIC).
Las tijeras CRISPR son muy útiles para inactivar genes y las técnicas de segunda y tercera generación de esta herramienta han permitido avanzar en distintos tipos de edición de pequeñas secuencias de ADN, subraya el investigador español, «pero para grandes alteraciones en los cromosomas, como inserciones, deleciones y grandes inversiones CRISPR no nos ha funcionado», no permiten obtener resultados de forma controlada y con eficacia significativa«, aclara.
Este nuevo sistema, por otra parte, podría superar ese obstáculo.
La nueva herramienta se basa en elementos móviles del genoma, elementos que son capaces de saltar de un lugar a otro del ADN. La técnica consigue controlarlos y dirigirlos a dianas concretas, para provocar una edición predeterminada. En concreto, el enfoque genera recombinasas, enzimas clave para la recombinación genética que actúan de forma programada en lugares concretos del genoma gracias a la guía que proporciona una molécula de ARN, llamada ARN ‘puente’.
En experimentos con bacterias Escherichia coliEl equipo ha demostrado una eficacia de inserción de la técnica de más del 60% con una especificidad del 94% en términos de correcta localización genómica.
«El laboratorio de Marc Gell propuso en 2021 su sistema FiCAT que combina una nucleasa del sistema CRISPR-Cas y una transposasa, la proteína que permite a los transposones, elementos genéticos móviles, ‘saltar’ a otro sitio del genoma para movilizar largos segmentos de ADN. , aunque dejando una marca a ambos lados del segmento insertado. Ahora Hsu utiliza otra familia de elementos móviles llamados IS -por inserción de secuencia- que codifican una pequeña recombinasa y una molécula de ADN también pequeña -llamada ARN puente- que contiene las secuencias complementarias. a los fragmentos de ADN de salida y llegada, que pueden ser reemplazados a voluntad, siendo por tanto capaz de insertar, eliminar e invertir fragmentos específicos y cantidades relativamente grandes de ADN de forma eficiente y relativamente segura», explica Montoliu.
El científico destaca que se trata de «un sistema muy compacto y con un gran potencial», aunque «todavía está asociado a un porcentaje nada despreciable de modificaciones en otros lugares similares del genoma y con una eficiencia variable que seguramente habrá que optimizar en proyectos futuros.»
Una limitación importante del estudio, continúa, «es que los experimentos sólo se han hecho en bacterias. No sabemos si funcionará en células humanas, aunque todo parece indicar que debería», concluye.









